直链淀粉与支链淀粉含量测定的方法与步骤
淀粉,这一天然高分子化合物,广泛存在于植物的根、茎和种子之中。其结构可划分为直链淀粉与支链淀粉两大类。直链淀粉,以D-葡萄糖基通过a-(1,4)糖苷键相连结,形成多糖链,具有独特的物理化学性质。而支链淀粉,其分子中不仅包含a-(1,4)糖苷键连接的糖链,还存在着a-(1,6)糖苷键的分支。这两种类型的淀粉在性质上有所不同:直链淀粉展现出抗润胀性,其水溶性欠佳,不溶于脂肪,且具有较高的糊化温度。然而,它的成膜性和强度相当出色,尽管在粘附性和稳定性方面稍逊于支链淀粉。相比之下,支链淀粉在水中的溶解度较低,但其水溶液能形成稳定的胶体。当支链淀粉经过加热糊化后,其分子链变得较为松散,从而赋予了它较高的粘度。值得一提的是,在淀粉糊冷却过程中,支链淀粉的分支结构会减弱分子链重新结合的紧密程度,进而展现出出色的抗老化能力。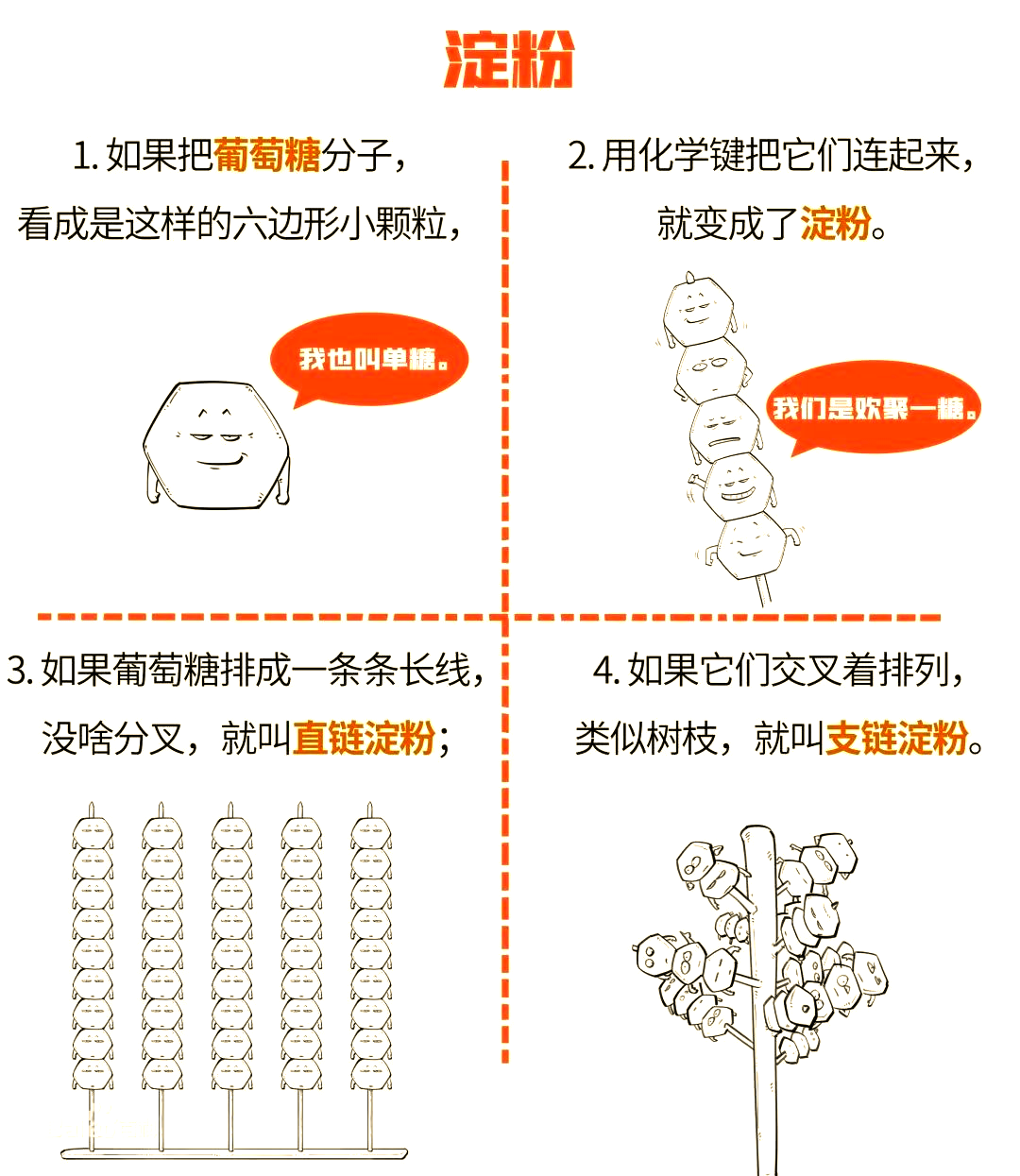
1、测定原理
基于双波长比色法,当试样溶液在两个波长处均具有吸收性时,这两个波长的吸光度差值与溶液中待测物质的浓度呈正比。通过分析待测样品液中直链淀粉和支链淀粉与碘反应生成的络合物的吸收图谱,我们可以确定出测定波长和参比波长。值得注意的是,淀粉与碘会形成具有特定颜色反应的螺旋状碘-淀粉复合物。具体来说,直链淀粉与碘反应生成纯蓝色的复合物,而支链淀粉与碘则依据其分支程度生成紫红到红棕色的复合物。因此,这两种淀粉与碘的反应会产生独特的光学特性,进而展现出特定的吸收光谱和吸收峰值。
2、试样制备
将新鲜样品通过组织捣碎机进行粉碎,随后放入60°C的鼓风干燥箱中烘干,直至其水分含量降至10%以下。之后,将烘干后的样品过孔径为0.25mm的试样筛。接下来,称取1g筛过的样品,置于索氏抽提器中,并加入35mL的石油醚进行加热回流脱脂,持续4小时。最后,再将处理过的样品放入鼓风干燥箱中进一步烘干,以去除残余的石油醚。
3、提取过程
将脱脂后的样品准确称取0.1000克,放入50毫升的容量瓶内。随后,向其中加入10毫升1摩尔/升的氢氧化钾溶液,并在75摄氏度的水浴中加热溶解20分钟。待溶液冷却后,用蒸馏水稀释至刻度,充分摇匀并静置15分钟,之后进行过滤操作。
4、标准曲线的绘制
(1)选择直链、支链淀粉的测定波长与参比波长
首先,将1.0 mL和5.0 mL的直链及支链淀粉标准溶液(浓度均为2 mg/mL)分别加入50 mL的容量瓶中。随后,加入25 mL的蒸馏水,用0.1 mol/L的盐酸溶液将pH值调至3.0。接着,加入0.5 mL的碘试剂,并用蒸馏水稀释至刻度,摇匀后静置25分钟。在室温下,使用双光束分光光度计对直链和支链淀粉进行可见光全波段扫描,从而得到它们的吸收曲线。根据吸收曲线,确定直链淀粉和支链淀粉的测定波长λ1、λ2,以及参比波长λ3、λ4。
(2)双波长直链、支链淀粉标准曲线的绘制
对于直链淀粉,分别吸取0.3 mL、0.5 mL、0.7 mL、0.9 mL、1.1 mL和1.3 mL的标准溶液,加入50 mL容量瓶中,并按照相同的方法进行处理。静置后,在λ1和λ3两个波长下,使用1cm的比色杯分别测定吸光度Aλ1和Aλ3,从而得到△A直= Aλ1-Aλ3。以△A直为纵坐标,直链淀粉的浓度为横坐标,绘制双波长直链淀粉的标准曲线。同理,对于支链淀粉,分别吸取不同体积的标准溶液,按照相同的方法处理并测定吸光度,绘制双波长支链淀粉的标准曲线。
5、样品测定
将提取好的5 mL滤液转移至50 mL容量瓶中,加入25 mL蒸馏水,用0.1 mol/L盐酸溶液将pH值调至3.0。接着,加入0.5 mL碘试剂,并用蒸馏水稀释至刻度,充分摇匀后静置25分钟。在室温条件下,使用双光束分光光度计,分别在λ1、λ2、λ3、λ4四个波长下测定样品液的吸收值Aλ1、Aλ2、Aλ3、Aλ4。通过计算△A样直和△A样支,与标准曲线进行比较,从而实现对样品中直链和支链淀粉的定量分析。
6、结果计算
每100克试样中直链淀粉和支链淀粉的含量,可以通过以下公式进行计算:
直链淀粉含量(g/100g)X1 = C1 * 50 * 10 * (1 - W1 - W2) / m / 1000 * 100
支链淀粉含量(g/100g)X2 = C2 * 50 * 10 * (1 - W1 - W2) / m / 1000 * 100
其中,C1和C2分别代表从标准曲线中查得的样品液中直链淀粉和支链淀粉的浓度,单位为毫克每毫升(mg/mL);m为测定时使用的脱脂样品的质量,单位为克(g);W1和W2则分别代表试样中的水分含量和粗脂肪含量,单位为克每百克(g/100g)。通过这些数据,我们可以精确地计算出样品中直链淀粉和支链淀粉的含量。




